Второй закон термодинамики. Энтропия.
Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает.
Существует два классических определения второго закона термодинамики:
Кельвина и Планка
- Клаузиуса
Не существует циклического процесса, который извлекает количество теплоты из резервуара при определенной температуре и полностью превращает эту теплоту в работу. (Невозможно построить периодически действующую машину, которая не производит ничего другого, кроме поднятия груза и охлаждения резервуара теплоты)
Не существует процесса, единственным результатом которого является передача количества теплоты от менее нагретого тела к более нагретому. (Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара)
Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает.
Второй закон связан с понятием энтропии (S) .
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
- 100% энергии не может быть преобразовано в работу
- Энтропия может вырабатываться, но не может быть уничтожена
Эффективность теплового двигателя
Эффективность теплового двигателя, действующего между двумя энергетическими уровнями, определена в пересчете на абсолютные температуры
η = (T h - T c) / T h = 1 - T c / T h
η = эффективность
T c = нижняя граница температуры (K)
Для того, чтобы достичь максимальной эффективности T c должна быть на столько низкой, на сколько это возможно. Чтобы эффект был 100% -м, T c должна равнятся 0 по шкале Kельвина. Практически это невозможно, поэтому эффективность всегда меньше 1 (менее 100%).
- Изменение энтропии > 0
Необратимый процесс - Изменение энтропии= 0
Двусторонний процесс (обратимый) - Изменение энтропии < 0
Невозможный процесс (неосуществимый)
Энтропия определяет относительную способность одной системы влиять на другую. Когда энергия двигается к нижнему энергетическому уровню, где уменьшается возможность влияния на окружающую среду, энтропия увеличивается.
Определение энтропии
Энтропия определяется как:
T = абсолютная температура (K)
Изменение энтропии системы вызвано изменением содержания темпла в ней. Изменение энтропии равно изменению темпла системы деленной на среднюю абсолютную температуру (T a):
Сумма значений (H / T) для каждого полного цикла Карно равна 0. Это происходит из-за того, что каждому положительному H противостоит отрицательное значение H.
- Тепловой цикл Карно
Цикл Карно— идеальный термодинамический цикл.
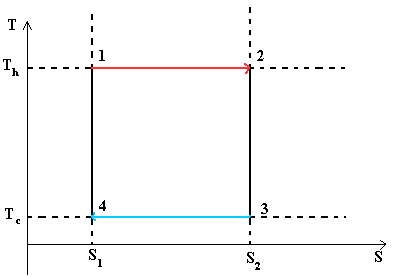
В тепловом двигателе, газ (реверсивно) нагревается (reversibly heated), а затем охлаждается. Модель цика следующая: Положение 1 --() --> Положение 2 --() --> Положение 3 --(изотермическое сжатие) --> Положение 4 --(адиабатическое сжатие) --> Положение 1
Положение 1 - Положение 2: Изотермическое расширение
Изотермическое расширение. В начале процесса рабочее тело имеет температуру T h , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Q H . При этом объём рабочего тела увеличивается. Q H =∫Tds=T h (S 2 -S 1) =T h ΔS
Положение 2 - Положение 3: Адиабатическое расширение
Адиабатическое (изоэнтропическое) расширение. Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Положение 3 - Положение 4: Изотермическое сжатие
Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру T c , приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты Q c . Q c =T c (S 2 -S 1)=T c ΔS
Положение 4 - Положение 1: Адиабатическое сжатие
Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
Законы термодинамики были определены эмперическим путем (эксперементально). Второй закон термодинамики - это обощение экспериментов, связанных с энтропией. Известно, что dS системы плюс dS окружающей среды равно или больше 0.
- Энтропия адиабатически изолированной системы не меняется!
Пример - Энтропия при нагревании воды
Процесс нагревания 1 кг воды от 0 до 100 o C (273 до 373 K)
При 0 o C = 0 кДж/кг (удельная - на единицу массы)
При 100 o C = 419 кДж/кг
Изменение удельной энтропии:
dS = dH / T a
= ((419 кДж/кг) - (0 кДж/кг)) / ((273 К + 373 К)/2)
= 1.297 кДж/кг*К
Пример - Энтропия при испарении воды
Процесс превращения 1 кг воды при 100 o C (373 K) в насыщенный пар при 100 o C (373 K) при нормальных условиях.
Удельная энтальпия пара при 100 o C (373 K) до испарения = 0 кДж/кг
100 o C (373 K) при испарении = 2 258 кДж/кг
Изменение удельной энтропии:
dS = dH / T a
= (2 258 - 0) / ((373 + 373)/2)
= 6.054 кДж/кг*К
Полное изменение удельной энтропии испарения воды - это сумма удельной энтропии воды (при 0 o C) плюс удельная энтропия пара (при температуре 100 o C).
Страница
2
Преуспевающим фирмам угрожает опасность того, что когда в системе происходит что-нибудь серьезное, они рискуют превратить благодатный цикл в порочный. Как это может произойти? Первый случай связан с парадоксом накопления - у вас может оказаться слишком много хорошего.
Достаточно большой успех делает вас высокомерными, самодовольными или алчными. Вы игнорируете новую технологию, потенциал которой позволяет предоставлять лучшие или более дешевые услуги, потому что ваш успех построен на старой технологии. Вы получаете такие значительные прибыли, что ваши менеджеры или профсоюзы увеличивают статьи расходов фирмы намного больше, чем конкуренты. Вы перестаете прислушиваться к потребителям; вы и так знаете, чего они хотят, к тому же они так назойливо мешают вам. Вы перестаете привлекать новые таланты или нанимаете талантливых людей, но не даете им сделать ничего нового.
Вы повышаете размеры, сложность, гетерогенность (неоднородность) фирмы, делаете ее менее управляемой и все менее похожей на родовую общину.
Если вы совершаете хотя бы одну из этих ошибок, можете распрощаться с надеждой на успех. В этом и состоит парадокс накопления.
Парадокс накопления в бизнесе - верный признак моральной порочности. Но второй из наших трех предупреждающих законов силы, закон энтропии, познакомит вас с аморальной физической силой, всегда готовой свести на нет любой из наших благородных порывов.
Закон энтропии
Понятие "энтропия" ввел немецкий физик Рудольф Юлиус Эмануэль Клаузиус для обозначения тенденции вещей к изнашиванию.
Люди стареют. Дома рушатся. Звезды сгорают. Утесы оседают в море.
Мир изменяется, и чтобы сохранить то, что у нас было раньше, мы должны сделать больше, чем сделали вчера. Вещи можно содержать в порядке или даже улучшить (краска на доме может выцвести, но дом можно покрасить снова еще лучше, чем раньше), но эта задача требует новых действий. Энергия системы разряжается и теряется, поэтому жизнь требует вливаний новой энергии.
Поддержание успеха требует постоянных усилий. Естественное состояние природы не равновесие, а энтропия. Конкурентное положение компании основывается на сложных взаимосвязях уникальных ресурсов и отношений, живых и беспокойных. Так же как любые системы и любые отношения, эти взаимосвязи, если о них не заботиться, не подкреплять и не обновлять, слабеют и распадаются. Противостоять энтропии вполне возможно. Но эта задача требует постоянных инноваций и улучшенного использования имеющейся в наличии энергии.
Закон непредусмотренных последствий
Третий общепринятый способ превращения успеха в поражение связан с непредусмотренными последствиями действий, предпринятых из лучших побуждений. Вот пример простейшего просчета, основанного на непонимании принципов работы систем.
Дитрих Дернер, профессор психологии Бамбергского университета в Германии, написал увлекательную книгу "Логика неудачи", в которой рассматривается вопрос, почему разумные люди и серьезные учреждения могут действовать осторожно и с наилучшими намерениями и все равно получать катастрофические результаты. Он говорит, что проблема заключается в наших моделях мышления, которые характеризуются линейностью, очередностью обдумывания деталей и привязанностью к причинно-следственным отношениям. В силу нашего неумения мыслить на языке систем и их взаимоотношений мы не можем охватить взглядом всю картину целиком и нагромождаем одни мелкие ошибки на другие, что в конечном итоге приводит нас к непредусмотренным и часто трагическим последствиям.).
Дернер приводит множество примеров катастроф. Почему высококвалифицированные инженеры, которые проектировали Асуанскую плотину и простая цель которых состояла в том, чтобы дать Египту дешевую электроэнергию, не осознали, что они прекратят ежегодные разливы реки, в течение тысячелетий обеспечивавшие богатство и плодородие долины Нила? Почему планировщики программ здравоохранения в бедных странах не учли, что увеличение численности населения приведет к резкому возрастанию потребности в пищевых продуктах и что без дополнительного производства пищи улучшение здравоохранения обернется для людей недоеданием, а порой и голодом?
Как избежать непредусмотренных последствий
Дитрих Дернер предлагает следующие рецепты:
Устанавливайте четкие, точные, позитивные и множественные цели. По возможности, цели должны быть конкретными. (Если мы этого не можем, то лучше делать что-нибудь кое-как, чем не делать ничего.)
Выстраивайте гипотезы и проверяйте их. Если мы сделаем х, то в результате получим а, b и с. Если нас устраивают а, b и с, то мы можем попробовать сделать х. Если ожидаемый результат получен не будет, по крайней мере, у нас останется дополнительная информация. Неправильные гипотезы можно исправить.
Используйте аналогии, чтобы прийти от того, что мы знаем, к тому, чего мы не знаем.
Думайте обо всем как о системе и постарайтесь идентифицировать все важные системные элементы. Постройте модель системы. Вы можете начать с одного элемента, но затем подумайте о его контексте. В примере с прудом можно начать с рыбки. Рыбка дышит, ест, испражняется. Ей нужен кислород. Что будет с отходами? Постепенно мы увидим, как стыкуются все элементы системы.
Думайте о проблемах, которые в данный момент не стоят перед вами, но могут появиться как побочные эффекты ваших действий. Подумайте о том, что может случиться через какое-то время. Вообразите потенциальные ловушки.
Не торопитесь приписывать все, что происходит, одной главной причине. Так бывает крайне редко.
Стройте симуляторы. Играя в игры, где на систему воздействует множество переменных величин, вы узнаете, как работает система, и сможете совершать ошибки, рискуя лишь воображаемыми наказаниями.
Одно обстоятельство, о котором не упомянул Дернер, но которое кажется мне очевидным, заключается в том, что самым эффективным лекарством от непредусмотренных последствий является человеческая изобретательность и адаптивность. Непредусмотренные последствия возникают, потому что мы живем в условиях нелинейных систем, совершаем изменения, действуем.
Резюме
Устойчивый успех строится на благодатном цикле. Но успех часто содержит семена саморазрушения. Благодатный цикл может превратиться в порочный, если успех меняет условия, которые привели вас к нему. В этом парадокс накопления: богатство разъедает желание радовать потребителей. Преуспевающие фирмы становятся вялыми и сложными. Там, где властвуют алчность, самодовольство и высокомерие, нет места успеху.
Помимо такого этического краха, вас подстерегают еще две опасности: энтропия и непредусмотренные последствия. Так же как все остальное, элементы бизнеса - идеи, технологии, отдельные люди, команды и корпорации - подвержены энтропии. Без технического обслуживания и обновления заводная пружина у этих элементов скоро ослабеет. Бизнес постоянно ощущает все более сильную нехватку энергии. Энтропия сильнее всего поражает вчерашних победителей. Успех нужно постоянно изобретать сначала, а прошедший успех затрудняет процесс достижения нового успеха. Самые тяжелые осложнения эта болезнь вызывает у фирм, которые поглощают больше стоимости, чем добавляют; их источник сотрудничества иссякает.
Понятие «энтропия» ввел немецкий физик Рудольф Юлиус Эмануэль Клаузиус для обозначения тенденции вещей к и изнашиванию. В 1865 году он писал:
«Я предлагаю назвать величину S [энергию, которой не хватает для работы] энтропией тела, от греческого слова превращение... Энергия Вселенной постоянна - энтропия Вселенной стремится к максимуму «.
Люди стареют. Дома рушатся. Звезды сгорают. Утесы оседают в море.
Закон энтропии - это перефразировка первых двух законов термодинамики, сформулированных за несколько лет до 1850 года в процессе поиска способов усовершенствования паровых двигателей. Французский физик Никола Леонар Сади Карно обнаружил, что процесс потери тепла можно направить на выполнение какой-либо работы. Англичанин Джеймс Пре-скотт Джоуль открыл явление конверсии: при каком-либо действии выделяется дополнительное тепло.
Первое начало термодинамики, которое сформулировали независимо друг от друга Джоуль и немецкий естествоиспытатель Юлиус Роберт Майер, утверждает, что энергию нельзя ни создать, ни уничтожить - она может только менять свою форму. Затем в 1850 году Клаузиус, основываясь на работах Карно, дал определение второго начала термодинамики: любая химическая система, будь то твердое тело, жидкость или газ, стремится к максимальному беспорядку. Поток энергии движется только в одном направлении, к термическому равновесию. Тепло передается от одного тела другому, и этот переход необратим. Тепло можно использовать только один раз - оно перетекает в более холодное тело, и извлечь его оттуда невозможно (не добавляя еще больше энергии). Великий шотландский ученый Джеймс Клерк Максвелл (1831–1879) заметил по этому поводу:
«Если вы бросите в море бокал, полный воды, вы не сможете достать из воды тот же самый бокал».
У закона энтропии есть параллели с двумя биологическими концепциями, рассмотренными нами в части первой: эффектом черной королевы и эволюционной гонкой вооружений. Мир изменяется, и чтобы сохранить то, что у нас было раньше, мы должны сделать больше, чем сделали вчера. Вещи можно содержать в порядке или даже улучшить (краска на доме может выцвести, но дом можно покрасить снова еще лучше, чем раньше), но эта задача требует новых действий. Энергия системы разряжается и теряется, поэтому жизнь требует вливаний новой энергии.
Поддержание успеха требует постоянных усилий. Естественное состояние природы не равновесие, а энтропия. Конкурентное положение компании основывается на сложных взаимосвязях уникальных ресурсов и отношений, живых и беспокойных. Так же как любые системы и любые отношения, эти взаимосвязи, если о них не заботиться, не подкреплять и не обновлять, слабеют и распадаются. Противостоять энтропии вполне возможно (иначе как бы мы смогли накопить столько материальных ценностей за последние 250 лет?), но эта задача требует постоянных инноваций и улучшенного использования имеющейся в наличии энергии.
Первое начало термодинамики
Макроскопические характеристики термодинамических систем. Расширенная формулировка закона сохранения энергии
Величины, характеризующие состояние макроскопических тел без учета молекулярного состояния тел (V, p, t) называются макроскопическими пораметрами (газ данной массы всегда занимает некоторый объем, имеет определенные давления и температуру).
Ø утверждает существование качественных видов энергии (механической, тепловой, электромагнитной) и присущую им способность при определенных условиях превращаться друг в друга;
Ø указывает, что в любых процессах, происходящих в замкнутых системах, численное значение энергии остается постоянным, т.е невозможность ее исчезновения или возникновения
Количественная формулировка первого начала термодинамики : количество теплоты (ΔQ), сообщенное телу, идет на увеличение ее внутренней энергии (ΔU)и на совершение телом работы (ΔA)
ΔQ=ΔU+ΔA
Работа, проделанная над телом, производит изменения его кинетической и потенциальной энергии. Следовательно, количество работы равно изменению его содержания энергии. Так как работа изменяет его уровень энергии, энергию можно определить как количество работы, которая содержится в веществе.
Первый закон термодинамики констатирует тот факт , что вечный двигатель (первого рода) невозможен, т.е. нельзя построить периодически действующую машину, которая бы совершала работу больше подводимой к ней извне энергии.
Экспериментальные исследования показывают, что в отличие от механического движения все тепловые процессы не обратимы, т.е реализация любого термодинамического процесса, при котором предполагается осуществление ранее пройденных тепловых состояний, но в обратном порядке, практически невозможна.
Всякая система стремиться перейти к состоянию термодинамического равновесия, в котором тела обладают одинаковыми температурами и давлением. Все термодинамические процессы, приближающиеся к тепловому равновесию, необратимы.
Сущность второго начала термодинамики:
1. тепло не может само собой переходить от холодных тел к более нагретым;
2. тепловая энергия равномерно распределяется между всеми телами, и всякие тепловые процессы в любой системе полностью прекращаются. Это приводит к тепловой смерти системы. Утверждение справедливо для замкнутых систем. Закон характеризует рост энтропии во времени.
Вечный двигатель второго рода, работающий за счет энергии находящихся в тепловом равновесии тел, невозможен.
Второе начало термодинамики указывает на существование двух различных форм энергии – теплоты (связанной с неупорядоченным движением) и работы (связанной с упорядоченным движением). Неупорядоченную энергию нельзя полностью перевести в упорядоченную. Мерой неупорядоченности в термодинамике является энтропия.
Энтропия (мера рассеяния энергии) (1865 Рудольф Клазиус ) – это функция состояния системы, характеризующая направление протекания самопроизвольных процессов в замкнутой системе.
Изменение энтропии термодинамической системы при обратимом процессе – это соотношение изменения общего количества тепла к величине абсолютной температуры ΔS= ΔQ/T
В замкнутой системе энтропия стремиться к максимуму.
Необратимыми называются такие процессы, которые могут самопроизвольно протекать только в одном направлении; в обратном направлении они могут протекать только как одно из звеньев более сложного процесса.
Количественная формулировка второго закона термодинамики : направление тепловых процессов определяется законом возрастания энтропии :
Ø энтропия замкнутой системы может только возрастать;
Ø максимальное значение энтропии замкнутой системы достигается в равновесии ΔS≥0
Ø чный двигатель второго рода невозможен!!! Все сказанное об энтропии показывает, что второй закон термодинамики, запрещающий ВД-2, незыблем. Житейское правило (особенно хорошо известное женщинам) , что беспорядок из порядка всегда возникает сам по себе, а наведение порядка всегда требует затраты работы, здесь оправдывается в полной мере.
Есть ли на Земле что-либо не подчиняющееся второму закону термодинамики? Иногда утверждают, что жизнь как таковая опровергает его. Нет. Жизнь в целом - это такая же термодинамическая машина, которая получает световую энергию от солнца и превращает ее в теплоту, совершая при этом какую-то работу и повышая энтропию окружающей среды. А ее виды (бактерии, водоросли, грибы, животные и т.д.) - всего лишь составляют единый механизм, достаточно сложный, но познаваемый. И в этом плане мы должны его рассматривать целиком, ведь при термодинамическом анализе двигателей, мы не выделяем в нем какую-нибудь мелкую деталь, вроде золотника.
Пусть при необратимом
процессе 1-
a
-2
система является адиабатически
изолированной. Так как адиабатический
процесс осуществляется без теплообмена
с окружающей средой
,
то приведенная теплота процесса1-
a
-2
равна нулю
 .
С учетом этого условия неравенства
.
С учетом этого условия неравенства и
и можно записать:
можно записать:
 и
и
 . (14.12)
. (14.12)
Полученные неравенства выражают закон возрастания энтропии :в любом процессе , который осуществляется в адиабатически изолированной системе , энтропия либо возрастает , либо остаётся постоянной.
Для равновесных
обратимых адиабатических процессов
 и
и ,
т.е. энтропия остается постоянной (S
= const).
,
т.е. энтропия остается постоянной (S
= const).
Если все процессы в системе, в конце концов, завершились, и система перешла из одного равновесного состояния в другое равновесное состояние, её энтропия имеет максимальное значение.
Итак, в произвольном (обратимом или необратимом) процессе любой термодинамической системы приращение энтропии больше или равно приведенной теплоте процесса:
 ;
;
 .
(14.13)
.
(14.13)
Знак равенства
имеет место для равновесных (обратимых)
процессов. В произвольном (обратимом
или необратимом) процессе с адиабатически
изолированной системой приращение
энтропии больше или равно нулю (энтропия
возрастает):
 ;
; ,
знак равенства имеет место для обратимых
процессов.
,
знак равенства имеет место для обратимых
процессов.
Тема 15 энтропия и вероятность. Термодинамическая вероятность
15.1. Энтропия
Итак, мы ввели
понятие
энтропии. Энтропия – функция состояния
системы. Если тело (или система тел) при
переходе из одного состояния в другое
на бесконечно малом участке этого
перехода получает бесконечно малое
количество теплоты
 ,
то отношение
,
то отношение является дифференциалом некоторой
функцииS
.
Эта функция–
энтропия:
является дифференциалом некоторой
функцииS
.
Эта функция–
энтропия:
 . (15.1)
. (15.1)
При обратимом процессе изменение энтропии:
 , (15.2)
, (15.2)
при этом изменение энтропии S не зависит от пути перехода из состояния 1 в состояние 2 .
Теплоизолированная (или замкнутая ) система – это система, не получающая и не отдающая тепла. Теоретически доказано, что в замкнутой системе все необратимые процессы протекают в сторону возрастания энтропии, т.е. S 0. В частном случае, когда все процессы системы обратимы, то изменение энтропии равно нулю, т.е. S = 0. Кратко выше сказанное можно записать так:
S 0, (15.3)
(знак равенства относится к обратимым процессам, знак неравенства – к необратимым). Выражение S 0 тоже является одной из формулировок второго начала термодинамики, энтропия – критерий обратимости и необратимости процессов. По тому, как изменяется S , можно узнать: обратим процесс или нет. Энтропия, так же как и внутренняя энергия, является важнейшей функцией, определяющей термодинамический процесс, поскольку именно энтропия определяет направление протекания процесса.
С огласно
второму началу термодинамики все
процессы в замкнутой системе происходят
в направлении возрастания энтропии.
Если система в конечном состоянии
находится в равновесном состоянии, то
энтропия достигает максимума, и все
процессы в системе прекращаются. Этот
вывод противоречит основным положениям
молекулярно-кинетической теории.
Рассмотрим, например (рис. 15.1), закрытый
сосуд, разделённый перегородкойАВ
на две одинаковые части 1 и 2. Пусть
сначала в части 1 сосуда находится N
молекул идеального газа, а в части 2 –
вакуум. В момент t
=
0
мгновенно уберем перегородку АВ
.
Газ начинает расширяться. Молекулы из
части 1 переходят в часть 2. Спустя
некоторое время возникнет обратный
поток частиц из части 2 в часть 1, после
чего начнется, и будет продолжаться
обмен молекулами между частями 1 и 2.
огласно
второму началу термодинамики все
процессы в замкнутой системе происходят
в направлении возрастания энтропии.
Если система в конечном состоянии
находится в равновесном состоянии, то
энтропия достигает максимума, и все
процессы в системе прекращаются. Этот
вывод противоречит основным положениям
молекулярно-кинетической теории.
Рассмотрим, например (рис. 15.1), закрытый
сосуд, разделённый перегородкойАВ
на две одинаковые части 1 и 2. Пусть
сначала в части 1 сосуда находится N
молекул идеального газа, а в части 2 –
вакуум. В момент t
=
0
мгновенно уберем перегородку АВ
.
Газ начинает расширяться. Молекулы из
части 1 переходят в часть 2. Спустя
некоторое время возникнет обратный
поток частиц из части 2 в часть 1, после
чего начнется, и будет продолжаться
обмен молекулами между частями 1 и 2.
Когда число молекул
N
1
и N
2
в обеих частях сосуда, а также потоки
туда и обратно станут одинаковыми,
наступит состояние равновесия. Это
состояние будет динамическое, а не
статическое равновесие. В состоянии
динамического равновесия
 почти никогда не выполняется, потому
что молекулы движутся хаотично, аN
1
и N
2
мгновенные значения числа молекул в
обеих частях сосуда. Однако среднее
число частиц за достаточно большой
промежуток времени в обоих частях сосуда
будет одинаковым и тогда можно записать:
почти никогда не выполняется, потому
что молекулы движутся хаотично, аN
1
и N
2
мгновенные значения числа молекул в
обеих частях сосуда. Однако среднее
число частиц за достаточно большой
промежуток времени в обоих частях сосуда
будет одинаковым и тогда можно записать:
 .
Самопроизвольные отклонения числа
частицN
1
и N
2
от средних значений обусловленные
тепловым движением молекул, называются
флуктуациями.
.
Самопроизвольные отклонения числа
частицN
1
и N
2
от средних значений обусловленные
тепловым движением молекул, называются
флуктуациями.
В рассматриваемом примере возможна такая ситуация, когда все молекулы газа, первоначально распределенные равномерно по всему объёму сосуда, самопроизвольно соберутся в одной из частей сосуда – в части 1 или в части 2. С точки зрения молекулярно-кинетической теории такая ситуация возможна, но при большом числе частиц маловероятна.
Энтропия – это функция состояния термодинамической системы, приращение которой равно приведенной теплоте равновесного перехода системы из начального состояния в конечное. Такое определение основывается на началах термодинамики. Рассмотрим молекулярно-кинетический смысл энтропии.
Следствием второго
начала термодинамики является закон
возрастания энтропии в адиабатически
изолированной системе. Все процессы в
адиабатически изолированной системе
происходят в направлении возрастания
энтропии:
,
где и
и – энтропия в конечном и начальном
состояниях. Если в термодинамической
адиабатически изолированной системе
все макропроцессы, которые могли
сопровождаться только увеличением
энтропии, завершены и система пришла в
состояние равновесия, то энтропия такой
системы имеет максимальное значение.
Таким образом,в
состоянии равновесия энтропия
адиабатически изолированной системы
максимальна.
– энтропия в конечном и начальном
состояниях. Если в термодинамической
адиабатически изолированной системе
все макропроцессы, которые могли
сопровождаться только увеличением
энтропии, завершены и система пришла в
состояние равновесия, то энтропия такой
системы имеет максимальное значение.
Таким образом,в
состоянии равновесия энтропия
адиабатически изолированной системы
максимальна.
Обратный переход такой системы из состояния с большей энтропией в состояние с меньшей энтропией невозможен , т.к. его осуществление противоречит второму началу термодинамики.
В молекулярно-кинетической теории для описания свойств термодинамических систем и процессов применяется понятие вероятности состояния. Тогда, используя понятие вероятности состояния, следствия второго начала термодинамики можно сформулировать так: всякий процесс в адиабатически изолированной системе представляет собой переход из состояния с меньшей вероятностью в состояние с большей вероятностью. Вероятность равновесного состояния максимальна. А переход системы из состояния с большей вероятностью в состояние с меньшей вероятностью невозможен.
Отсюда следует, что понятие энтропии и вероятности состояния должны быть тесно связаны между собой. Найдем эту взаимосвязь.




